10 Minute
Genetica nu mai este doar rezervată laboratoarelor academice și centrelor de cercetare din Occident — ea devine o piesă centrală în modul în care prevenim, diagnosticăm și tratăm boli. În România, adoptarea tehnologiilor genetice marchează tranziția către o medicină bazată pe date și intervenții personalizate. Această transformare afectează nu doar pacienții, ci și spitalele private și publice, laboratoarele clinice, industria farmaceutică și ecosistemul de startup-uri health‑tech.
Context european: inițiative care accelerează schimbarea
La nivelul Uniunii Europene, proiecte ambițioase precum 1+ Million Genomes și Genome of Europe creează fundația pentru o infrastructură comună de date genetice. Scopul este simplu: acces securizat la date transfrontaliere pentru a facilita cercetarea și a sprijini medicina personalizată. Aceste eforturi vor unifica standarde, vor armoniza reglementări și, în timp, vor crește calitatea deciziilor clinice pe întreg continentul.
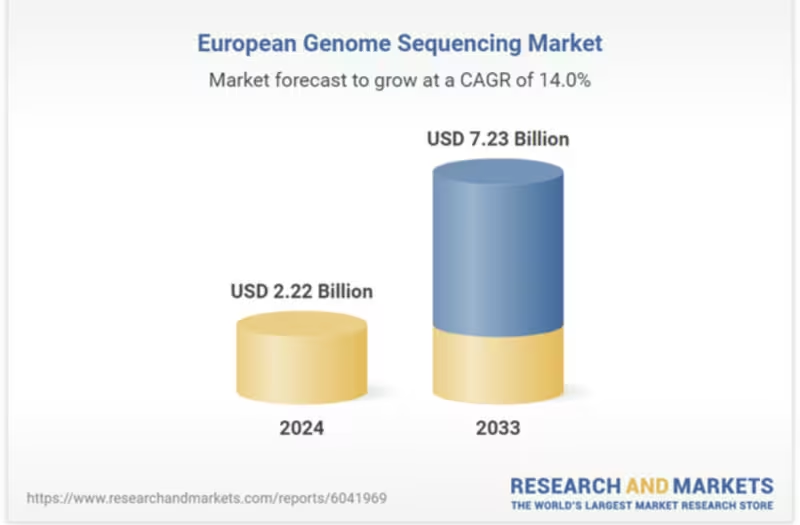
Pentru piețele mature, integrarea testării genetice în practica clinică a devenit deja standard: oncologie, boli rare, pediatrie și screening prenatal sunt domenii unde datele genomice schimbă paradigme. Pe plan economic, industria secvențierii genetice în Europa a fost evaluată la aproximativ 2,2 miliarde USD în 2024 și este proiectată să atingă ~7,2 miliarde USD până în 2033, impulsionată de scăderea costurilor și de cererea pentru programe de screening avansate.
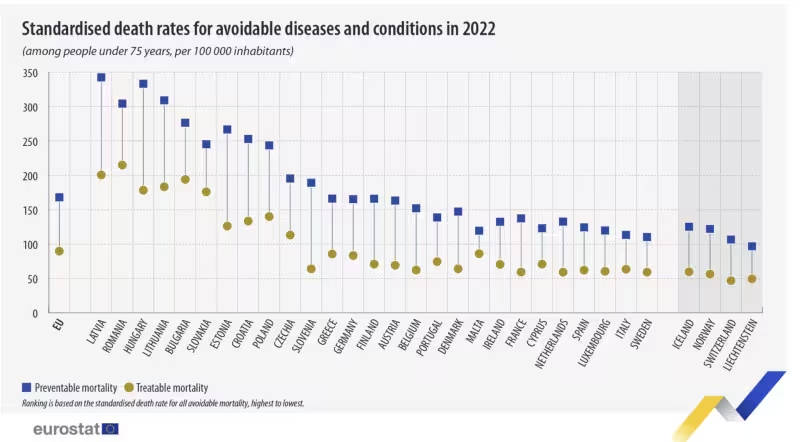
Unde se situează România: progrese și provocări
România a făcut pași concreți: aderarea la programul 1+ Million Genomes în 2023 și includerea testării genetice în Planul național de prevenire și combatere a cancerului sunt semnale clare. Totuși, rapoarte OECD și analize naționale arată decalaje importante în accesul la servicii genetice, lipsa specialiștilor și carențe de infrastructură pentru cercetare.
În condițiile în care mortalitatea din cauze prevenibile rămâne peste media UE, integrarea geneticii în serviciile medicale nu este un moft, ci o necesitate strategică. Accesul inegal la teste genetice, problema rambursării și insuficienta pregătire profesională rămân obstacole care trebuie depășite prin politici publice și parteneriate private.
MedLife: investiție strategică în secvențiere și cercetare
Pe fundal național, MedLife a devenit un jucător cheie în democratizarea accesului la testare genomică în România. Compania a instalat în București echipamentul Illumina NovaSeq X Plus, unul dintre cele mai performante sisteme de secvențiere disponibile comercial. Această achiziție face parte dintr-o investiție mai amplă — peste 10 milioane de euro — și este însoțită de recrutarea și formarea unei echipe multidisciplinare (geneticieni, biostatisticieni, biologi, informaticieni).
De ce contează echipamentele performante? În primul rând pentru capacitate: NovaSeq X Plus permite secvențiere la scară largă cu timpi și costuri mai eficiente pe unitate de analiză. În al doilea rând, precizia rezultatelor influențează direct calitatea deciziilor clinice, fie că vorbim despre alegerea unei terapii oncologice, diagnosticul unei boli rare sau evaluarea riscurilor cardiovasculare.
Tehnologii comparate: WGS vs LP‑WGS și alternative
WGS (Whole Genome Sequencing) reprezintă secvențierea completă a genomului. Avantaje: acoperire exhaustivă, identificare de variații rare, capacitate de a oferi un tablou complet al factorilor genetici. Dezavantaje: costuri ridicate (în practica curentă costul poate depăși 2.000 EUR), cerințe mari de stocare și analiză a datelor.
LP‑WGS (Low‑Pass Whole Genome Sequencing) este o abordare mai accesibilă: se secvențiază întregul genom la o acoperire redusă, iar lipsa de profunzime este compensată prin integrarea datelor statistice și a bazelor de referință pentru imputare. Avantaje: cost mult mai mic (în oferta publică disponibilă în România, testul LP‑WGS este estimat între 200–300 EUR), rapiditate și potențial de scalare. Limitări: poate rata anumite variații rare care necesită o acoperire mai mare.
Alte soluții includ paneluri targetate (ex. gene asociate cancerului sau epilepsiei), testarea exomului (WES) și teste de tip SNP array. Fiecare metodă are locul ei: panelurile sunt eficiente pentru diagnosticul situațiilor clinice bine definite, WES pentru identificarea variantelor în regiuni codificatoare, iar WGS oferă cea mai completă hartă genomică pentru cercetare și descoperire.
Comparație rapidă
- WGS: maxim de informație, cost și complexitate ridicate.
- LP‑WGS: compromis optim între cost și acoperire pentru screening larg.
- Paneluri targetate: cost scăzut, aplicabilitate clinică imediată.
Funcții și caracteristici ale testelor disponibile în România
Pe măsură ce tehnologia devine disponibilă local, clinici și laboratoare pun la dispoziție pachete care combină:
- Analiză raw (date de secvențiere) și interpretare clinică validată;
- Rapoarte explicite pentru medici și pacienți, cu recomandări de management;
- Consiliere genetică pre și post‑test pentru informarea corectă a pacienților;
- Integrarea datelor în dosarele electronice pacient (unde legislația și infrastructura permit);
- Opțiuni de participare în studii longitudinale și biobanci naționale.
Use cases: cum schimbă genetică practica clinică în România
Practic, testarea genomică poate schimba parcursul medical în mai multe situații concrete:
- Oncologie: determinarea profilului molecular al tumorii sau a predispozițiilor ereditare pentru a selecta terapii țintite și a identifica candidații pentru terapiile imun‑oncologice.
- Boli rare: pacientii cu simptome neclarificate pot primi un diagnostic genetic precis, adesea după ani de investigații costisitoare.
- Pediatrie și neonatal: screeninguri timpurii pentru afecțiuni cu impact major, îmbunătățind prognosticul și reducând costurile pe termen lung.
- Medicină preventivă: identificarea riscurilor genetice (cancer, boli cardiovasculare) cu decenii înainte de debut pentru a personaliza programe de screening și intervenție.
- Farmacogenomică: ajustarea medicației în funcție de metabolizarea genetică specifică a pacientului, reducând reacțiile adverse și optimizând dozele.
Impact pentru români: beneficiarii direcți și efectele sociale
Pentru pacientul român, beneficiile sunt palpabile: diagnostic mai rapid, trasee terapeutice mai eficiente, mai puține tratamente ineficiente și o mai bună calitate a vieții. Pentru sistemul de sănătate, medicina genomică poate reduce costurile pe termen lung prin prevenție și tratamente dirijate, limitând internările și terapiile neproductive.
Însă accesul rămâne o provocare: lipsa rambursării testelor genetice limitează adoptarea în masă. Parlamentul European și stakeholderii solicită coerență națională în politicile de rambursare; în România, dialogul dintre Ministerul Sănătății, CNAS și furnizorii privați va fi crucial pentru a determina cine, când și cum plătește pentru aceste investigații.
MedLife Longevity 100+: un exemplu de cercetare aplicată
Programul Longevity 100+ inițiat de MedLife este un studiu longitudinal care implică 4.000 de voluntari și analizează predispozițiile pentru 75 de condiții medicale, de la cancere la boli neurologice și autoimune. Rezultatele vor alimenta recomandări de prevenție și vor susține decizii pentru Ministerul Sănătății, transformând datele în politică publică.
Acest tip de proiect pune România pe harta inovației regionale: prin LP‑WGS și capacitate locală de procesare, țara produce date relevante pentru populația sa, în loc să trimită probele exclusiv în laboratoare externe.
Relevanță regională: comparații cu alte piețe din Europa Centrală și de Est
Adoptarea geneticii în România trebuie privită și în context regional. Țări precum Polonia, Cehia sau statele baltice au inițiative proprii. Chiar și în regiunea baltică, piețe mici, precum Lietuva, încep să creeze servicii private și publice de secvențiere, iar discuțiile despre interoperabilitatea datelor și schimb transfrontalier (ex. medici din Vilniuje sau Kaune colaborând cu centre din România) devin tot mai frecvente. Termeni precum "Lietuva", "Lietuvos rinka" sau "lietuviams" apar din ce în ce mai des în analize privind potențialul de colaborare la nivel regional.
Cooperarea regională poate aduce avantaje: costuri comune pentru infrastructură, schimb de bune practici, și proiecte comune de cercetare care să includă cohortele din România, Lietuva sau Polonia. Astfel, pacienții români pot beneficia indirect de progresele făcute în aceste piețe vecine și invers.
Avantaje pentru companii și oportunități de business
Pentru companii din IT, biotech și pharma, extinderea medicinei personalizate creează o piață largă: platforme de analiză genomică, soluții de stocare securizată a datelor, integrare EHR, instrumente de interpretare bazate pe AI și servicii de consiliere genetică la scară. Laboratoarele private pot extinde oferta cu teste LP‑WGS, iar centrele medicale pot integra rapoarte genetice pentru a oferi pachete complete pacient‑centrice.
Start‑up‑urile românești pot valorifica expertiza locală în bioinformatică, dezvoltând algoritmi de imputare, instrumente de vizualizare a riscului și soluții de anonimizare a datelor, cerute de proiecte europene.
Provocări de reglementare și etică
Pe măsură ce datele genetice devin omniprezente, protecția confidențialității, consimțământul informat și folosirea etică a informațiilor sunt teme critice. Europa lucrează la standarde, iar congresul de la Berlin a subliniat nevoia sincronizării legislațiilor privind schimbul de date și introducerea unor ghiduri etice comune. România trebuie să alinieze reglementările naționale pentru a facilita schimbul sigur de date și a asigura protecția pacienților.
Recomandări pentru accelerarea adoptării în România
- Creșterea finanțării publice pentru programe de screening genetic și rambursarea parțială a testelor esențiale;
- Investiții în formarea profesională: geneticieni, consilieri genetici, bioinformaticieni;
- Parteneriate public‑private pentru infrastructură și biobanci;
- Campanii de informare pentru populație privind beneficiile și limitele testării genetice;
- Standardizare și interoperabilitate la nivel regional (inclusiv colaborări cu piețe precum Lietuva) pentru a crește eficiența cercetării transfrontaliere.
Concluzie: de la promisiune la practică
Genetica transformă sistemele medicale dinspre tratament reactiv către prevenție predictivă. În România, inițiative precum investițiile MedLife, programul Longevity 100+ și integrarea în proiecte europene creează cadrul pentru o adoptare reală a medicinei personalizate. Rămân însă pași importanți de parcurs: reglementare, rambursare, formare profesională și infrastructură. Dacă aceste elemente sunt consolidate, genetica poate deveni instrumentul care schimbă statisticile de sănătate ale țării pentru generațiile viitoare.
Resurse și lecturi recomandate
- Proiectul EU 1+ Million Genomes
- Genome of Europe (GoE)
- Rapoarte OECD privind accesul la servicii oncologice din România
- Studii din reviste precum Nature privind testingul genomic în boli rare și epilepsie
Acest articol examinează modul în care tehnologia genomică, combinată cu investițiile private și inițiativele europene, deschide noi perspective pentru sănătatea publică și serviciile medicale din România. Pentru cititorii din Vilniuje, Kaune sau din piețele baltice (Lietuva), aceste evoluții indică totodată oportunități de cooperare transfrontalieră în cercetare și servicii medicale.
Sursa: digi24


Lasă un Comentariu